人工合成牛胰岛素,开启了胰岛素类药物发展的新里程
发布日期:2021-08-04 来源:PSM志愿者人工合成牛胰岛素
人工合成牛胰岛素是新中国成立以来最大的创新科研之一,也是世界上第一次人工合成的与天然胰岛素化学结构相同并具有完整生物活性的蛋白质,标志着人类在揭示生命本质的征途上实现了里程碑式的飞跃。同时,胰岛素的发现与实现人工合成,也彻底改变了糖尿病人的生存现状,为人类带来了福泽。
胰岛素的人工合成,开启了胰岛素类药物发展的新里程
1921年,加拿大的班廷和贝斯特首先发现了胰岛素,1922年开始用于临床,使过去不治的糖尿病患者的生命得到挽救。但是,用于临床的胰岛素几乎都是从猪、牛等动物的胰脏中获得的,与人的稍有差别,且不同动物的胰岛素组成也有所差异。动物提取的胰岛素存在质量难以控制、工艺复杂、价格昂贵等一系列问题,限制了胰岛素的临床应用。
1958年,中科院生化所组织近20人的精干专业队伍,开启了胰岛素的人工合成之路。经过多年攻关,在1965年9月17日,科学家终于观察到人工全合成牛胰岛素的结晶,世界上第一次人工全合成了与天然胰岛素分子相同化学结构并具有完整生物活性的蛋白质。就这样,这项由中科院生化所、中科院有机所和北京大学协作完成的工作,从1958年12月正式立项至1965年9月观察到结晶,前后历时近七年。该工作开启了胰岛素类药物发展的新里程,被誉为“前沿研究的典范”,并于1982年荣获国家自然科学奖一等奖。

图1 参与胰岛素人工合成的科学家代表
如何选择胰岛素类药物?
胰岛素药物能够降低血糖水平,对于维持I型和II型糖尿病患者的血糖稳定有重要作用。但是,胰岛素注射液在体内消除快,为达到治疗效果需要频繁给药,导致患者依从性差。通过基因重组技术得到的胰岛素类似物,这些经过结构改造的胰岛素类似物具有速效、中效、长效的不同降血糖效果。临床上,门冬胰岛素,谷赖胰岛素,是速效胰岛素。甘精胰岛素,地特胰岛素,是长效胰岛素。与速效胰岛素相比,长效胰岛素药物注射给药后缓慢吸收、释放、进入血液,降血糖作用持续时间长,可以减少给药次数,但起效慢。
将速效、中效、长效的不同降糖速率的胰岛素类似物以不同比例混合可以达到不同降血糖要求,能够达到快速降糖、持续时间长的效果。礼来公司研发的降糖药优泌乐25,是由25%赖脯胰岛素和75%精蛋白锌赖脯胰岛素混合而成的注射液,这是一种短中效结合的胰岛素。此外,将赖脯胰岛素水溶液与锌、鱼精蛋白溶液混合后,会得到结晶状的赖脯胰岛素—鱼精蛋白锌复合物,该复合物具有起效快、作用时间长的特点。临床上通过联合使用具有不同降血糖效果的胰岛素类似物,以模拟正常人体内胰岛素的分泌模式,达到良好的血糖控制效果[1,2]。
胰岛素类药物只能注射给药吗?
胰岛素类药物可以达到起效快、维持时间长的降血糖效果。目前,大多数的胰岛素类药物注射液已设计成预填充注射笔,大大改善了患者的使用体验,但是长期注射给药任然伴随疼痛、局部组织坏死、感染及神经损伤等不良反应。
为了提高患者的生活质量和用药方便性,胰岛素的非注射新型给药方法在近几年得到了广泛研究,包括口服、鼻腔、肺部、皮肤等给药方式:
1、口服胰岛素给药
方便、经济、完全无痛,是患者最乐意接收的给药方式之一。但是,胰岛素类药物直接口服会被降解,失去生物学活性,不能发挥降血糖效应。那么,有么有办法保护胰岛素在胃肠道内不被降解呢?科学家研究发现给胰岛素穿上纳米“保护衣”,比如脂质体、纳米粒、微球、微囊等载体,就可以减少胃肠道环境对胰岛素的破坏和降解,促进其有效吸收,期望这些纳米载体能够早日实现胰岛素的口服给药。
2、鼻腔给药
就是药物通过鼻黏膜细胞下丰富的血管和淋巴管吸收后直接进入血液循环。MDRNA公司开发的速效胰岛素鼻腔喷雾剂,可通过辅助设备(如鼻喷雾瓶)集中在鼻内给药。
3、肺部给药
有助于药物快速吸收。曼恩凯德生物医疗公司的胰岛素肺吸入剂Afrezza(人胰岛素)。美国食品药品监督管理局批准其用于I型和II型糖尿病患者在就餐时间段的胰岛素给药,该药品不能替代长效胰岛素,但它仍为数量庞大的糖尿病患者群提供了较方便的治疗方式。
4、皮肤给药
是最方便、安全的给药方式之一,但是我们的皮肤角质层阻挡的绝大多数药物经过皮肤吸收。现今,研究热门的微针贴片可在皮肤的表面创建微米级、暂时性的孔道,帮助胰岛素类药物透过皮肤,吸收进入血液发挥降血糖效果。实验表明,微针中90%的胰岛素在25℃或37℃下能保存1个月。相信在不久的将来,糖尿病患者只需要在皮肤上贴上小小的微针贴片,就可以精准降糖啦[3,4]。
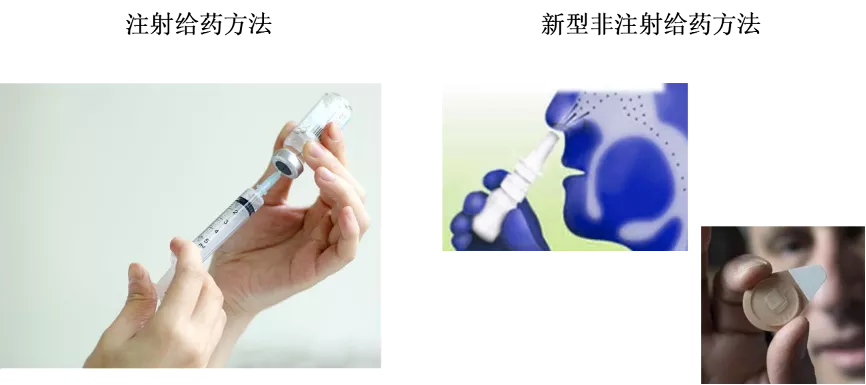
图 胰岛素的给药方法
胰岛素从发现至今约有100年的历史,中国人实现胰岛素完全人工合成也逾55年。胰岛素精神代代相传,人们对胰岛素的探索与创新从未停止,速效化、长效化和实现非注射给药是胰岛素类药物发展的主流思想,预计在不久的将来,胰岛素可以实现非注射、精准释放的智能化递送要求,更好的服务于患者。
审稿专家:上海市皮肤病医院/同济大学附属皮肤病医院 朱全刚

- 胰岛素必须放冰箱吗?糖尿病用药的几个冷知识2026-01-26
- 外出旅行,胰岛素怕“失效”!药师教你如何避免2025-12-05
- 依柯胰岛素,一名“一周一针”的控糖好帮手2025-11-12
- 肠易激综合症用药避坑指南2025-10-19
- 如何破除老人使用胰岛素成瘾的误区?2025-10-15









