什么是药物临床试验?
发布日期:2017-12-09 来源:华中科技大学同济医学院附属同济医院“有医无药医无用,有药无医药不灵”。药物自古以来便是医生治病救人的有力武器,每年都有新的药物被制药公司研发出来,但这些从实验室里创造出来的物质还不能称之为真正意义上的药物,在其正式上市前需经过严谨、科学的临床药物试验,以确保其安全性和有效性,相比于已有药物能够对患者带来更好的临床获益。
新药在进入临床试验前已经经过了严格的药学研究(例如理化性质、制剂工艺等)和药理学研究(实验动物药效学研究、药理学研究、毒理学研究)。虽然有些药物可能在实验动物身上获得了较好的有效性和安全性数据,但毕竟人与动物间存在种属差异(全新药物从来没有在人身上使用过),且有些药物的毒性并非即刻显现,故非常有必要先在小范围人群中开展临床药物试验,确定其安全、有效后逐步放大,直至最终上市。因此,药物临床试验是新药研发必不可少的关键环节。

图1反应停事件:20世纪60年代初期,联邦德国一家制药厂生产的安眠药反应停(沙利度胺)因对妊娠呕吐疗效明显,在欧洲各国、澳大利亚、加拿大、拉丁美洲与非洲等地争相上市,使用极为广泛。1961年10月,联邦德国妇产科学术会议报告了沙利度胺引起的海豹型畸胎,并总结了从1956-1961年间发生畸形胎儿6000~8000例。然而在美国,该药品正在FDA监督管理下进行着临床试验,尚未批准上市,因此美国仅有9名这样的胎儿出生,没有使更多的人受害。
一个完整的新药临床试验共分成四个阶段(即I、Ⅱ、III、Ⅳ四期)。其中前三期为新药上市前的临床试验,第四期为上市后的临床试验。
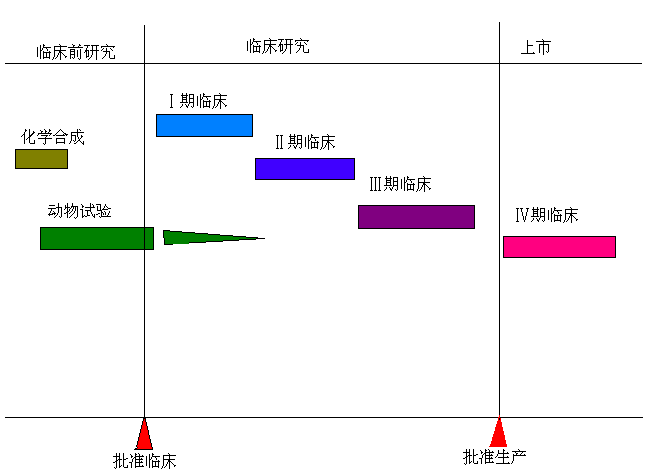
图2新药研发流程图
I期临床试验是新药进行人体试验的起始期。以20~30名健康志愿者为主要受试对象,进行初步的临床药理学及人体安全性评价试验,观察人体对新药的耐受程度和药代动力学,为制定给药方案提供依据。
Ⅱ期临床试验是以新药预期应用的患病人群样本为对象,初步评价治疗作用的阶段。其目的是初步评价药物对目标适应证患者的治疗作用和安全性,同时也为Ⅲ期临床试验研究设计和给药剂量方案的确定提供依据。
III期临床试验试验应尽可能接近该药的正常使用条件,可看作是Ⅱ期临床试验的放大,其设计常采用多中心、开放、随机、对照试验,通过增加样本量(试验组病例不少于300例和对照100例)并根据试验目的的调整选择受试者标准,适当扩大特殊受试人群,及更为丰富的观察项目或指标等措施,进一步考察不同对象所需剂量及依从性。
Ⅳ期临床试验是新药上市后由申请人自主进行的应用研究阶段。其目的是考察在广泛使用条件下药物的疗效和不良反应;评价在普通或者特殊人群中使用的利益与风险关系;改进给药剂量等。新药Ⅳ期临床试验是新药临床试验的一个重要组成部份,是对I、Ⅱ、Ⅲ期临床试验的补充和延续。它可以弥补上市前临床试验缺乏的资料和信息,为临床合理用药提供依据。
在药物临床试验中,除了新药研发公司和医疗机构的研究者外,最重要的参与者当属受试者。受试者是新药临床试验的作用对象,然而当今中国社会对受试者的认识还存在误解,有的媒体甚至会用“试药人”、“小白鼠”来称呼他们,并伴随着不少关于这一邻域的负面报道。实际上,受试者不仅是被动承担研究的载体,更是药物临床试验的重要合作者,没有受试者就没有新药的诞生,可以说我们每个人都在仰仗着他们享受现代医药的发达成果。在国家相关法律法规和行业规范不断完善的今天,受试者的安全健康和合法权益已能够得到充分保护,也有越来越多的大学生参与其中,为我国新药研发事业和中国人的身体健康默默贡献着自己的力量。相比于西方发达国家,我国的新药研发起步晚、基础差。但随着国家在新药研发领域科研经费投入和人才队伍的不断壮大,我们相信在不久的将来,会有越来越多来自中国的创新药物造福人类社会。
审稿专家:华中科技大学同济医学院附属同济医院 孙明辉

相关文章
标签 药物临床试验
- 解读关键字:药物临床试验2021-05-02
- 药物临床试验知多少?2021-04-07
- 药物临床试验是个什么鬼?2018-09-19









